Efecto del ácido valproico, tricostatin A y resveratrol sobre la diferenciación del adipocito
Johana Brochero1, Diana Vargas1, Carolina Romero1, Luis Gustavo Celis1, Fernando Lizcano1
1Universidad de La Sabana, Facultad de Medicina, Centro de Biología Molecular.
Correspondencia: johana_lu@hotmail.com , fernando.lizcano@unisabana.edu.co
Recibido: 14-04-09 / Aceptado: 22-05-09
La obesidad es un factor de riesgo de enfermedades coronarias, de cáncer, de accidentes cerebrovasculares y de diabetes tipo II. El propósito de este trabajo es evaluar la capacidad del ácido valproico, tricostatin A y resveratrol como agentes que reduzcan la diferenciación de preadipocitos. Los dos primeros, inhiben la actividad de las histonas deacetilasas tipo I y II, mientras que el resveratrol es un activador de la enzima sirtuina 1 perteneciente a la familia de las histonas deacetilasas dependientes de dinucleótidos de nicotinamida adenina. Esta reprime la actividad trascripcional mediada por el receptor de proliferación del peroxisoma mediante su asociación con represores, evidenciado en la movilización de ácidos grasos en células adiposas.
Para el estudio se utilizó la línea celular de preadipocitos de ratón 3T3-L1 en presencia de un cóctel de diferenciación con rosiglitazona, isobutilmetilxantina y dexametasona. Al día 8 de la diferenciación, se aplicaron las dosis de los tres agentes objeto de estudio y se llevaron a cabo observaciones cada dos días hasta el día 12. Se evaluó la acumulación de depósitos de grasa mediante tinción rojo-aceite y se cuantificaron la cantidad de triglicéridos en cada tratamiento. El ácido valproico, tricostatin A y resveratrol presentaron una disminución en la diferenciación del adipocito maduro, debido a que la cantidad de triglicéridos dentro del mismo fue menor con respecto a las células tratadas con ROSI. Sin embargo, el resveratrol presenta una mayor diferencia significativa. Nuestros resultados destacan el papel de los inhibidores de las histonas deacetilasas y la actividad de sirtuina 1 en la adipogénesis que es bloqueada por los tratamientos con los tres agentes, siendo el resveratrol el agente que presenta mayor reducción de la diferenciación del adipocito.
Palabras clave: ácido valproico, adipogénesis, resveratrol, sirtuina 1, rosiglitazona.
Effect of valproic acid, trichostatin A and resveratrol in adipocyte differentiation.
Obesity is a risk factor of coronary diseases, cancer, vascular brain disorders, and diabetes type II. The purpose of this work is to evaluate the capacity of valproic acid, trichostatin A and resveratrol agents in the reduction of fat accumulation in the adipocyte cell. Valproic acid and trichostatin A inhibit histone deacetilase activity type I and II, while resveratrol is a sirtuin 1 activator belonging to the family of nicotinamide dinucleotidsdependent deacetylases histones. Furthermore, Sirt1 represses the activity mediated by PPARã by means of its association with repressors, showed in the mobilization of fatty acids in adipocyte cells. For this study, mouse preadipocytes 3T3-L1 cell line was used and treated it in the presence of a differentiation cocktail containing rosiglitazone, isobutilmetilxantine and dexametasone. In the 8th day of differentiation doses of valproic acid, trichostatin and resveratrol were added, monitoring each two days until day 12 of differentiation.
The fat storage by oil red-O solution was evaluated assessing the triglyceride quantity in each treatment. All the treatments presented a reduction in the adipocyte differentiation, because the amount of triglycerides was lower in comparison to the cells differentiated by rosiglitazone. However, the resveratrol presented a greater meaningful difference. Overall our results highlight a role for HDAC and Sirt1 activity in adipogenesis, which can be blocked by treatment with valproic acid, trichostatin A and resveratrol, being resveratrol the agent that presents the greatest reduction in adipocyte differentiation.
Keywords: adipogenesis, resveratrol, rosiglitazone, trichostatin A, valproic acid.
La obesidad es un trastorno metabólico y nutricional de serias consecuencias para la salud. Se reconoce el alto riesgo que representa la obesidad en la incidencia de varias enfermedades crónicas: hipertensión arterial, enfermedad isquémica coronaria, accidentes cerebro-vasculares, diabetes tipo 2 y ciertas formas de cáncer, que son causa importante de morbilidad y mortalidad en el mundo (1). Por tal motivo, el estudio de la función de nuevos factores reguladores de la diferenciación y proliferación de la célula grasa es pieza fundamental para reconocer la base molecular de las complicaciones generadas por el adipocito y tratar de establecer planes terapéuticos.
El ácido valproico (VPA) es un fármaco antiepiléptico que impide la aparición de las crisis convulsivas y es un estabilizador del estado de ánimo para el tratamiento del trastorno bipolar y cefaleas crónicas. VPA presenta efectos secundarios tales como: sedación y cambios en el peso (2). Más del 70% de los pacientes adultos que reciben tratamiento con VPA han aumentado de peso entre 5 a14 kg (3). Sin embargo, en el tratamiento con VPA de células preadipocitas 3T3–L1, obtenidas a partir de fibroblastos de ratón, se ha evidenciado una reducción de la diferenciación del adipocito (4). Lo que nos hace pensar que es necesario dilucidar los mecanismos de acción de este medicamento, pues probablemente tenga un origen multifactorial, ya sea sobre el centro del hambre y saciedad o sobre el adipocito.
El tricostatin A (TSA) es un compuesto orgánico que sirve como antibiótico y antifúngico, que inhibe selectivamente la clase I y II de las histonas deacetilasas (HDAC) (5). TSA tiene algunos usos como medicamento contra el cáncer, debido a que inhibe el ciclo celular en eucariotas durante el comienzo de su etapa de crecimiento (6). Otro mecanismo sugerido es que TSA promueve la apoptosis en células cancerosas, retardando la progresión del cáncer (7).
El papel de la actividad HDAC en la diferenciación del adipocito no está bien definido. Sin embargo, trabajos recientes han estudiado su inhibición en la activación transcripcional de los genes adipogénicos in vitro, incluidas la proteína potenciadora de unión a CCAAT (C/EBP), el receptor de proliferación del peroxisoma (PPARg), y la proteína de unión regulada por elementos esteroides SREBP (4).
El resveratrol (3,4’,5-trans-trihydroxystilbeno) (RESV) es un compuesto polifénolico encontrado en varias fuentes vegetales como la uva y en una gran variedad de plantas medicinales. Este funciona como una fitolexina que protege a las plantas contra infecciones por hongos. En los últimos años el interés en esta molécula ha aumentado, debido a que puede tener otros efectos tales como quimioprotector en algunos modelos de cáncer, efectos positivos sobre varios aspectos del metabolismo prolongado el tiempo de vida de todos los modelos de metazoos probados hasta ahora, incluidos los pequeños mamíferos (8).
También se ha observado su participación en la activación de la SIRT 1. Esta enzima es un histona deacetilasa tipo III, que cataliza una hidrolisis simple de acetillisina en presencia de NAD+. Los miembros de la familia de las s juegan un papel importante en los procesos biológicos como la movilización de los ácidos grasos en los adipocitos, secreción de la insulina, respuesta a estrés celular, degeneración axonal, activador de factores de transcripción basal, regulador de la actividad enzimática, recombinación de rADN y apoptosis (9). En células en cultivo se ha mostrado que puede inhibir el ciclo celular e inducir a la apoptosis vía la ruta de señalización MAP quinasa o por la inhibición de las proteínas involucradas en la traducción de éstas al igual que efectos antiinflamatorios, antioxidantes y cardioprotectores (10,11).
Estas notables propiedades han suscitado un gran interés hacia la identificación de proteínas en las que actué el RESV y que conduzcan a la identificación de las enzimas inhibidas y activadas por el mismo. Las evidencias de la farmacología de los estudios de diversos compuestos, indican que el VPA, TSA y RESV pueden desempeñar un papel importante con acción directa o indirecta sobre el metabolismo lipídico, actuando como inhibidores de HDAC (VPA y TSA) y como activadores de SIRT 1 (RESV), antagonistas de PPARg.
Cultivo celular y diferenciación
Se utilizó la línea celular de fibroblastos de preadipocitos de ratón 3T3-L1 proveniente de la colección ATCC. Las células son mantenidas en medio de Dulbecco´s modificado de Eagle´s (DMEM) con suero fetal bovino inactivado (FBS) al 10% y penicilina/estreptomicina al 1%, e incubadas a 37ºC y 5% de CO2. El medio es cambiado cada dos días y los preadipocitos son mantenidos al 95% de confluencia
Para este trabajo se utilizaron 5 tratamientos: control negativo, células preadipocitas 3T3–L1 sin ningún tratamiento para inducir diferenciación; control positivo (Rosiglitazona) células 3T3-L1 tratadas con inductores para promover la diferenciación, VPA, TSA y RESV.
Para la diferenciación de 3T3-L1, dos días después de que las células alcanzaron una confluencia del 100%, se agregó un cóctel para inducir la diferenciación que contenía dexametasona 1μM, metil isobutil xantina 0.5 mM y Rosiglitazonaglitazona a 1 μM. Luego de 48 horas se cambió el medio de cultivo y el cóctel de diferenciación por sólo el medio de cultivo más Rosiglitazona 1μM.
Posteriormente se cambió el medio DMEM cada dos días. El VPA 1mM, TSA 5nM y RESV 50μM fueron diluidos en Me2SO <0.1% y adicionados el día 8 de la diferenciación. Finalmente se realizaron observaciones a los 0, 2, 4, 6, 8 y 10 días después de la aplicación del cóctel de diferenciación.
Tinción rojo aceite y determinación de TGC
Las células son teñidas con rojo aceite y cuantificadas como lo describen Kasturi and Joshi (12). Se realizó una extracción de lípidos con 5 mL de isopropanol para luego leer la absorbancia del extracto a 510 nm.
Análisis estadístico
Se realizó la prueba de Análisis de Varianza (Anova) y las diferencias fueron consideradas estadísticamente significativas cuando el valor de la media con error estándar fue de p < 0.001.
Inhibición de la diferenciación del adipocito
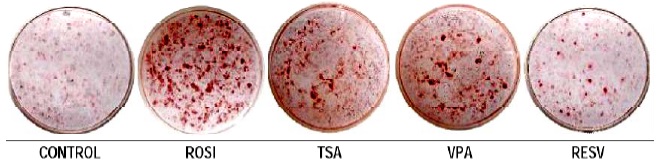
Para determinar si el VPA, TSA y RESV podían inducir inhibición de la diferenciación en células 3T3-L1, las células fueron cultivadas con cóctel de diferenciación y tratadas con VPA 1mM, TSA 5nM y RESV 50μM; después de 11 días en cultivo se observó menor cantidad de TGC (TGC) en estos tratamientos con respecto al tratamiento con Rosiglitazona que es utilizado como control positivo, el cual mostró una alta acumulación de lípidos en forma de gotas de grasa observadas con el rojo aceite, Figura 1. Estas observaciones nos indican la acción de estos compuestos como agentes inhibitorios de la adipogénesis.
El proceso de diferenciación es evidenciado por la acumulación de TGC en el citoplasma de las células en cultivo, las cuales se encuentran al 100% de confluencia.

Figura 1. Inhibición de la diferenciación del adipocito. Gotas de lípidos, coloración rojo aceite día 11 de la diferenciación del adipocito, Control (control -), ROSI (control +), VPA, TSA y RESV.
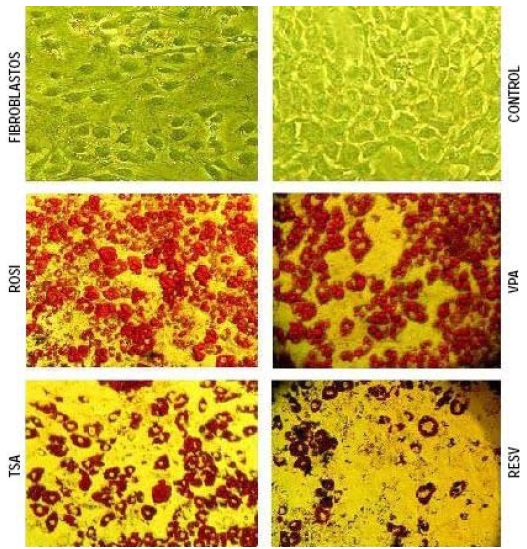
Figura 2. Fotografías microscopia óptica (200 X) de células en cultivo usando las mismas condiciones de A. Los resultados obtenidos nos permiten observar el efecto inhibidor del VPA, TSA y RESV sobre las células adiposas, ya que las concentraciones de TGC dentro de las mismas son menores con respecto a las células tratadas con rosiglitazona.
Durante las observaciones al día 0, 2, 4, 6, 8 y 10 después de la aplicación del cóctel de diferenciación, se visualizaron las células de todos los tratamientos, excepto las células del tratamiento control, con una morfología bien definida característica del adipocito adulto hasta el día 9, en donde después de la aplicación de VPA, TSA y RESV se van reduciendo la cantidad de ácidos grasos contenidos en el adipocito, inhibiendo el proceso adipogénico, Figura 2.
La cuantificación de TGC muestra que el RESV es el tratamiento que más se acerca al control negativo en comparación con VPA y TSA, ya que el RESV>CONTROL 1.3 veces, mientras que TSA>CONTROL 2.8 y VPA>CONTROL 3.6 veces, los controles positivo y negativo se encontraron Rosiglitazona>CONTROL 5.6 veces; no hay diferencia significativa entre VPA>TSA 1.2, pero si entre VPA>RESV 3.0 y TSA>RESV 2.4. Respecto al control positivo de la diferenciación vemos que los tres tratamientos presentan una reducción de Troglicéridos, sin embargo, el RESV sigue confirmando una mayor actividad, como lo muestran los datos, Rosiglitazona>VPA 2.5, Rosiglitazona>TSA 2.8 y Rosiglitazona>RESV 4.7, Figura 3.
Cuantificación de TGC en adipocitos en cultivo.
Se confirma que el tratamiento con RESV reduce significativamente la diferenciación del adipocito con respecto a VPA y TSA. Las datos están representados como absorbancia a 510 nm comparados con Rosiglitazona (*p < 0.001, **# p < 0.001).
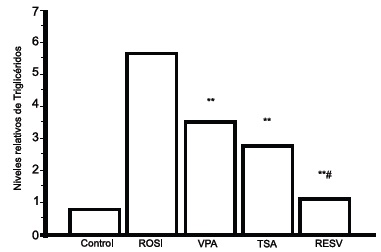
Figura 3. Cuantificación de Triglicéridos en adipocitos en cultivo. Se confirma que el tratamiento con RESV reduce significativamente la diferenciación del adipocito con respecto a VPA y TSA. Las datos están representados como absorbancia a 510 nm comparados con ROSI (*p < 0.001, **# p < 0.001).
Se evidenció una reducción de los depósitos de TGC citoplasmáticos, por lo que la expresión morfológica característica del adipocito está acompañada de alteraciones en el metabolismo lipídico celular. La movilización de TGC está asociada a un efecto lipolítico de los tratamientos, sin embargo no es posible afirmar tal mecanismo de acción por lo que concluimos que reduce la diferenciación del adipocito.
La actividad inhibitoria de HDAC tipo I y II del VPA y TSA, promueve la expresión de genes por inhibición de HDAC debido a que interfiere y evita la eliminación de grupos acetil de las histonas, esta modificación permite que el ADN reduzca su afinidad con proteínas histonas, iniciando el proceso de transcripción que finalmente va a dar origen, en la mayoría de casos, a una proteína de interés a partir de la expresión del gen blanco. Este mecanismo sugeriría un aumento en la actividad de los factores de transcripción involucrados en el proceso adipogénico obteniendo una mayor diferenciación de los adipocitos.
Nuestros resultados evidenciaron el efecto contrario, por lo que es posible que los mecanismos de acción de estos compuestos no estén asociados a una represión directa de genes adipogénicos, incluidos la proteína C/EBP, PPARg, y SREBP. Por lo que es necesario dilucidar de qué modo actúan sobre el adipocito.
Un posible mecanismo de acción del RESV, probablemente está involucrado con la activación de la Sirt 1, enzima perteneciente a la familia de histonas deacetilasas, que al parecer reprime los genes que dirigen la diferenciación del adipocito y almacenamiento de ácidos grasos, controlados por el factor de transcripción PPARg, mediante la asociación de su cofactor NCoR y SMRT evidenciado en células 3T3- L1 (11).
Dado que el VPA, TSA y RESV, tienen diversos mecanismos de acción es difícil comprender completamente en qué forma actúan sobre la diferenciación del adipocito, ya sea con acción directa o indirecta sobre la movilización de lípidos. Se demostró que el tratamiento con RESV tiene una mayor acción sobre la reducción de la diferenciación casi hasta niveles nulos de acumulación de TGC, en comparación con el control negativo. El tratamiento con VPA y TSA reducen también los niveles de TGC, pero no son tan significativos como el RESV.
Otros estudios han demostrado que el RESV también tiene efecto lipolítico, por lo que los resultados obtenidos en este trabajo confirman que esta fitolexina puede ser de gran utilidad en el tratamiento de estas patologías (13-15). Con la implementación de nuevas tecnologías y avances en el área de las biociencias, los investigadores poseemos las herramientas necesarias para la búsqueda de nuevas alternativas que permitan dilucidar los mecanismos de prevención y tratamiento para intentar disminuir el incremento de la prevalencia de obesidad observado en nuestro país y sobre todo sus consecuencias para el futuro.
1. Fu M, Sun T, Bookout AL, Downes M, Yu RT, Evans RM, Mangelsdorf DJ. A Nuclear Receptor Atlas: 3T3-L1 Adipogenesis. Mol Endocrinol. 2005; 19:2437-2450.
2. Macritchie KA, Geddes JR, Scott J, Haslam DR, Goodwin GM. Valproic acid, valproate and divalproex in the maintenance treatment of bipolar disorder. Cochrane Database Syst Rev. 2001;3:CD003196.
3. Jallon P, Picard F. Bodyweight Gain and Anticonvulsants: A Comparative Review. Drug Saf. 2001;24:969–978.
4. Lagace DC, Nachtigal MW. Inhibition of histone deacetylase activity by valproic acid blocks adipogenesis. J Biol Chem. 2004;279:18851–18860.
5. Vanhaecke T, Papeleu P, Elaut G, Rogiers V. Trichostatin A-like hydroxamate histone deacetylase inhibitors as therapeutic agents: toxicological point of view. Curr Med Chem 2004;11:1629-1643.
6. Drummond DC, Noble CO, Kirpotin DB, Guo Z, Scott GK, Benz CC. Clinical development of histone deacetylase inhibitors as anticancer agents. Annu Rev Pharmacol Toxicol. 2005;45:495-528.
7. Shankar S, Srivastava RK. Histone deacetylase inhibitors: mechanisms and clinical significance in cancer: HDAC inhibitor-induced apoptosis. Adv Exp Med Biol. 2008;615:261-298.
8. Baur JA, Sinclair D. Therapeutic potencial of resveratrol: the in vivo evidence. Nat Rev Drug Discov. 2006;5:493-566.
9. Sauve AA, Wolberger C, Schramm VL, Boeke JD. The biochemistry of sirtuins. Annu Rev Biochem. 2006;75:435-465.
10. Alkhalaf M. Resveratrol-induced growth inhibition in MDAMB- 231 breast cancer cells is associated with mitogen-activated protein kinasa signalling and protein translation. Eur J Cancer Prev. 2007;16:334-341.
11. Picard F, Kurtev M, Chung N, Topark-Ngarm A, Senawong T, Machado De Oliveira R, Leid M, et al. Sirt1 promotes fat mobilization in white adipocytes by repressing PPARg. Nature. 2004; 429:771-776.
12. Kasturi R, Joshi VC. Hormonal Regulation of Stearoyl Coenzyme A Desaturase Activity and Lipogenesis during Adipose Conversionof 3T3-Ll Cells. J Biol Chem. 1982;257:12224-12230.
13. Celis LG, Rozo C, Garay J, Vargas D, Lizcano F. Efecto Lipolítico del Resveratrol en células 3T3-L1. Salud Uninorte. 2008;24:165-171
14. Puigserver P, Wu Z, Park CW, Graves R, Wright M, Spiegelman BM. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis. Cell. 1998;92:829–839.
15. Lagouge M, Argmann C, Gerhart-Hines Z, Meziane H, Lerin C, Daussin F, Messadeq N, et al. Resveratrol improves mitochondrial function and protects against metabolic disease by activating SIRT1 and PGC-1alpha. Cell. 2006;127:1109-1122